Неалкогольная жировая дистрофия печени. Симптомы и лечение
Два года тому назад умер один из больных, за которым я наблюдала последние девять лет до его смерти. Если бы смерть наступила вследствие инфаркта или хронической сердечной недостаточности, это был бы один из ожидаемых исходов, которые можно часто видеть в терапии в подобных случаях. И, наверное, ничего нового и интересного я бы не смогла рассказать коллегам.
Причиной смерти этого больного была гепатоселлюлярная карцинома печени с метастазами.
Мистер Дж.С., 1936 года рождения, был направлен семейным доктором на консультацию к специалисту внутренних болезней с целью уточнения плана лечения и обследования (если необходимо).
История болезни (диагнозы): диабет, тип 2; дислипидэмия (повышение холестерина и др. нарушения липидного обмена); гипертония; ишемическая болезнь сердца; хроническая мерцательная аритмия; ожирение. Никогда не курил и не употреблял алкоголь.
Лечение: метформин, аторвастатин, бета-блокаторы, антагонисты ангиотензинрецепторов и варфарин (варфарин или кумадин) – это антикоагулянт, который мы даем для профилактики эмболического инсульта при мерцательной аритмии, т.к. при этих нарушениях ритма могут образовываться небольшие эмболы в левом предсердии, «стреляющие» в сосуды мозга. Если бы у него не было мерцалки, то он бы был просто на аспирине).
При рутинном обследовании все анализы крови были нормальны, за исключением печеночных проб (слегка повышены). Диабет был также под хорошим контролем, уровень НвА1С – 6,7%.
Заключение ультразвукового исследования (УЗИ) печени: жировая инфильтрация печени.
Несколько лет больной приходил на консультацию 1-2 раза в году по направлению семейного врача и обследовался в связи с дополнительными проблемами: железодефицитная анемия в 2006 году (гастроскопия, колоноскопия, аспирация костного мозга), повторные УЗИ печени в 2002 и 2004, анализы крови. УЗИ в 2006 году подтвердило цирроз печени без признаков портальной гипертензии. Уровень альфа-фетопротеина (маркер гепатоселлюлярной карциномы) был нормальным в этом же году. С тех пор УЗИ и альфа-фетопротеин проверялись тщательно каждые 6 месяцев.
В 2007 году варфарин отменили в связи в осложнением (гематома мягких тканей в области левой лопатки). Признаков анемии больше не наблюдалось.
Больной чувствовал себя хорошо.
В очередной визит анализ крови показал значительное повышение альфа-фетопротеина – 188 Ug/l (норма< 10). УЗИ не показало ничего нового, кроме цирроза печени. Повторный уровень альфа-фетопротеина – 51Ug/l.
В начале 2008 года уровень альфа-фетопротеина вырос до 318Ug/l, и на УЗИ печени определили очаг 3,4 х 3,7 см в 6 сегменте печени плюс несколько мелких (0,5 – 1,5 см) очагов в обоих долях печени. Трехфазный КТскэн подтвердил очаги, которые определили УЗИ-исследованием.
Больной был направлен к гастроэнтерологу (гепатологу) для лечения. После хемоэмболизации больной вернулся для симптоматического лечения. Последующее лечение в связи с множественными очагами в печени не рекомендовалось (сделано было все возможное в данном конкретном случае). Альфа-фетопротеин снизился до 16Ug/l .
Последующие 18 месяцев больной чувствовал себя хорошо. Дважды был в стационаре по нескольку дней с респираторной инфекцией и гастроэнтеритом.
За три недели до смерти поступил в стационар, т.к. плохо себя чувствовал, нарастала одышка, нуждался в кислороде. В легких на рентгене – множество метастазов. Уровень альфа-фетопротеина был 1620Ug/l.
Прогресс жировой инфильтрации (от первой постановки диагноза) до цирроза занял 5 – 6 лет и еще через 2 года развился рак печени. Возможно, развитие заболевания у этого больного было очень быстрым.
Чаще такие больные раньше умирают от сердечнососудистых заболеваний, инсультов, осложнений диабета (например, почечная недостаточность).
В связи с глобальной эпидемией ожирения и диабета мне показалось, что тема жировой дистрофии печени (особенно неалкогольной) может быть интересной. Исход этого заболевания, пусть и нечасто, может быть очень серьезным, и правильное наблюдение и регулярные обследования таких больных могут помочь в своевременном диагнозе и лечении.
Жировая инфильтрация печени (ЖИП) и неалкогольный стеатогепатит (НАСГ)
По определению ЖИП – это инфильтрация жиром 5% и более гепатоцитов.
Неалкогольная жировая дистрофия печени (НАЖДП) включает в себя ЖИП, стеатогепатит и стеатонекроз.
Неалкогольный стеатогепатит (НАСГ) имеет более серьезный прогноз и близок к алкогольному гепатиту.
НАСГ является сегодня самым частым заболеванием печени в мире.
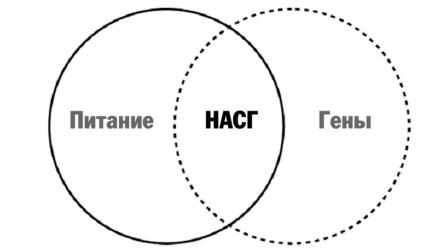
Факторы риска, способствующие развитию НАСГ: метаболический синдром, ожирение, диабет 2 типа, дислипидемия (нарушение липидного обмена), сердечнососудистые заболевания, поликистоз яичников. Распространенность НАСГ в мире 2,8% – 46% (зависит от тестов, которые использовали при постановке диагноза).
Международное определение метаболического синдрома:
– центральное ожирение (отложение жира в области живота) с окружностью талии более 94 см у мужчин и более 80 см у женщин;
– повышенный уровень триглицеридов в крови более 1,7 ммоль/л;
– липиды (холестерол) высокой плотности ниже 1,03 ммоль/л у мужчин и ниже 1,29 ммоль/л у женщин;
– артериальное давление – систолическое выше 130 и диастолическое – выше 85 мм;
– глюкоза крови натощак выше 5,6 ммоль/л или диабет 2 типа.
НАСГ присутствует у 94% людей с ожирением (ИМТ* выше 30); у 64% людей с повышенным весом (ИМТ 25 – 29) и у 25% – с нормальным весом. Неклассический фенотип, когда нормальный ИМТ, но центральное ожирение наиболее часто встречается у азиатского населения (40%).
Больные с диабетом 2 типа имеют НАСГ в 40 – 70% случаев.
НАСГ является субкатегорией НАЖДП. Гистологические критерии НАСГ включают жировую инфильтрацию гепатоцитов и воспаление.
Есть данные о сочетании НАСГ и криптогенного (идиопатического – незвестная причина) цирроза печени. Обычно более тяжелое течение, и для оценки тяжести нужна биопсия печени. Генетическая предрасположенность и стиль жизни (диета, физическая активность) в сочетании могут приводить к развитию НАСГ в значительном проценте случаев. Например, американцы африканского происхождения имеют НАСГ 24%, белое население – 33%.
Клинические симптомы НАСГ очень часто отсутствуют.
Небольшое количество пациентов могут ощущать дискомфорт в правом подреберье, усталость. У детей бывает пигментация на коже шеи, спины, подмышек (Acantosis nigricans).
Исключение других заболеваний печени (гепатит В, С, гемохроматоз, болезнь Вилсона – ненормальный обмен меди, опухоль, холангит) очень важно для диагноза НАСГ.
Начальные обследования включают билирубин и печеночные пробы, альбумин, глобулины, уровень липидов и глюкозы натощак, уровень железа и показатели обмена железа (трансферин, феритин и т.д.), уровень тиреоидных гормонов, аутоиммунные показатели для исключения заболеваний соединительной ткани и аутоимунных гепатитов. Свертывающие показатели крови часто не обязательны, т.к. коагулопатии развиваются позже при развитии печеночной недостаточности.
УЗИ печени в комбинации с вышеуказанными анализами крови достаточно для постановки диагноза. КТскэн также не является обязательным.
Биопсию печени нужно делать, если:
– сомнительный диагноз;
– пациент имеет высокий риск фиброза печени, но еще без признаков цирроза печени;
– если пациент включен в клинические исследования;
– если пациент имеет другую операцию и легко доступна биопсия печени.
Ни один из выше перечисленных тестов не может предсказать течение заболевания.
УЗИ и КТскэн имеют субоптимальную чувствительность, печеночные пробы тоже не очень сильно могут предсказать развития стеатоза и фиброза. Есть данные, что отношение АСТ к АЛТ выше 1(AST/ALT>1) и высокий уровень триглицеридов могут указывать на более тяжелое течение болезни.
Даже биопсия печени (золотой стандарт для диагноза) может зависеть от места биопсии и полученного материала.
УЗИ-критерии для диагноза НАЖДП (G.C. Farrell и соавторы, 2007) (для диагноза нужны два из трех критериев).
1. УЗИ-картина:
– диффузно повышенная эхогенность печени («яркий» сигнал или «яркая» печень);
– «размытость» сосудов (нечеткие сосуды);
– глубокое ослабление (attenuation) ультразвукового сигнала.
2. Все другие причины заболевания печени (гепатит С, В, склерозирующий холангит, первичный биллиарный цирроз, гемохроматоз) должны быть исключены.
3. Прием алкоголя (чистого алкоголя!) должен быть менее 140 г в неделю у мужчин и менее 70 г в неделю у женщин.
Одна стандартная доза алкоголя – 7 г (1 drink). Это 30 мл крепких напитков (водка, коньяк и т.д.), или 150 мл вина, или 330 мл «легкого» (2,5 градуса) пива.
Течение и прогноз неалкогольной жировой дистрофии печени
У 5 – 20% больных с НАЖДП и у 15 – 30% больных с НАСГ развивается цирроз печени. За 5 – 18 лет происходит трансформация жировой инфильтрации в цирроз, а у больных с НАСГ этот период короче.
Общая продолжительность жизни больных обычно не меняется, т.к. другие серьезные заболевания (диабет, ИБС, инсульт) и осложнения метаболического синдрома приводят к смерти зачастую раньше, чем формируется цирроз печени и его последствия. Прогноз значительно ухудшается, когда присутствует другое заболевание печени (например, гепатит С).
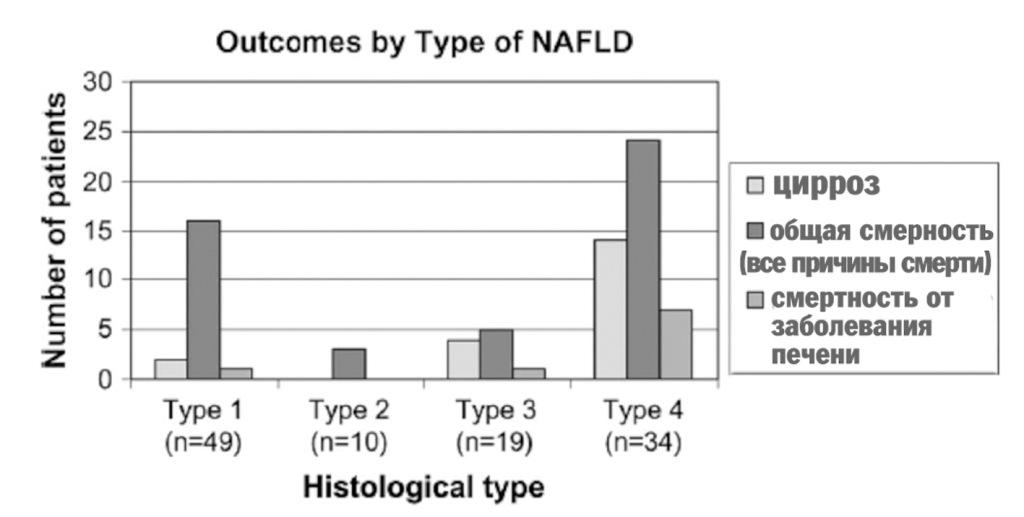
Сравнение исхода заболевания при различных типах НАЖДП в зависимости от гистологического варианта. При втором типе цирроз не развивается, при 4 типе – самая большая общая смертность и смертность, связанная с заболеванием печени.
Лечение жировой дистрофиии печени
1. Диета и физическая активность, как и при диабете 2 типа (низкокалорийная, низкий гликемический индекс).
2. Потеря веса на 6 – 10%:
– может нормализовать анализы крови (печеночные пробы);
– улучшить гистологию печени;
– уменьшить содержание жира в печени;
– улучшить (уменьшить) резистентность к инсулину.
3. Употребление алкоголя должно быть исключено полностью.
4. Медикаментозное лечение
(Orlistat, Sabutramine, Metformin).
Орлистат – ингибитор желудочной и панкреатической липазы, предупреждает всасывание триглицеридов; сабутрамин – серотонин и норадреналин ингибитор используют для лечения ожирения в комплексе с диетой и физическими упражнениями. Метформин уменьшает резистентность к инсулину и может быть полезен даже при отсутствии диабета. Нужны дополнительные исследования, чтобы доказать пользу метформина при НАЖДП без диабета.
Хирургическое лечение ожирения (Bariatric surgery) также способствует значительной потере избыточного веса и улучшает состояние печени.
Нерандомизированные исследования подтверждают эффективность некоторых препаратов для лечения триглицеридэмии (пробикол и гемфиброзил-Gemfibrosil). Клофибрат в рандомизированном исследовании не подтвердил свою эффективность. Витамины С, Е, урсодеоксихолевая кислота, пробиотики также не подтвердили свою эффективность в рандомизированных исследованиях.
Гепатоселлюлярная карцинома (ГЦК)
ГЦК является сегодня пятой по частоте из всех онкологических заболеваний и третьей причиной смертности от рака. Гепатиты В и С ответственны за 78% глобальных случаев ГЦК. 15 – 50% (по разным данным) случаев ГЦК являются исходом криптогенных (неизвестная причина) циррозов печени. НАСГ скорее всего занимает большую часть из всех случаев криптогенных заболеваний печени. Сравнение НАСГ и алкогольного цирроза печени проведены в ряде исследований.
E.Hashimoto и соавторы (2004) показали, что больные с НАСГ обычно более старшего возраста (68 лет в среднем), в большинстве случаев женщины (63%) с повышенным весом или ожирением и более половины из них (63%) страдают диабетом 2 типа и гипертонией (50%).
В связи с эпидемией ожирения и диабета к 2020 году количество случаев ГЦК как результат НАСГ увеличится (20% от общего числа ГЦК). Иммунизация против гепатита В позволит снизить случаи ГЦК как результат хронической вирусной инфекции (J.M.Page, S.A.Harrison, 2009).
Канцерогенез при НАСГ
Резистентность к инсулину (гиперинсулинемия) является фактором риска для развития некоторых видов рака (кишечник, эндометрий, поджелудочная железа).
IGF-1 (insulin growth factor-1) ингибирует apoptosis (смерть или разрушение) клеток и стимулирует клеточную пролиферацию. Инсулин стимулирует рост клеток путем активации IRS-1(insulin receptor substrate-1). Клетки гепатомы имеют повышенную экспрессию (over expression) IGF-1 и IRS-1. В 60% случаев ГЦК клетки гепатомы имеют еще и IRS-2, который также повышает пролиферацию клеток и снижает апоптоз.
Случаи ГЦК, описанные недавно в литературе, указывают, что не только НАСГ с выраженным фиброзом, но и НАЖДП с менее выраженным фиброзом могут приводить к ГЦК (G.Gusman и соавторы, 2008; ретроспективное исследование 2004-2007).
Лечение ГЦК
В настоящее время имеется несколько видов лечения рака печени.
1. Резекция (хирургическое удаление очага ГЦК).
2. Хемоэмболизация (использование химиотерапевтических препаратов для эмболизации очагов ГЦК) с Lipidol, Doxorubicin, Cisplatin.
3. Radiofrequency ablation (это когда «радиотоками убивают-выжигают опухоль. Некоторые центры используют это лечение (как 1-й выбор) при маленьких опухолях.
4. Пересадка (трансплантация) печени.
5. Новые методы (направленные на молекулы антитела) – Sorafenib (multikinase inhibitor) в настоящее время в стадии клинических исследований.
Указанные виды лечения проводят в крупных специализированных центрах по лечению заболеваний печени и онкологических клиниках.
Прогноз ГЦК зависит от размера опухоли, количества очагов и сосудистой инвазии (проростание в сосуды).
При маленьких солитарных опухолях (два и менее сантиметра) без вовлечения сосудов выживаемость в среднем составляет 3 года у > 75% больных и 5 лет у >50% больных. Некоторые исследования подтверждают хорошую эффективность комбинированного лечения (резекция + radiofrequency ablation) при мультифокальных опухолях (84% выживают год и 61% – пять лет).
В связи с достигнутыми успехами в лечении ГЦК важно вовремя поставить диагноз и направить больного к специалисту. Профилактика ГЦП сводится к лечению заболеваний печени, которые могут приводить к развитию ГЦК.
P.S. В подробном описании эффективности каждого вида лечения в данном случае нет надобности, поскольку для семейного доктора важно вовремя направить такого больного на своевременное лечение.
Зоя ВОЛОБУЕВА
к.мед.н., врач госклиники
г. Тоовомба, Австралия